Chuyên đề Hóa học lớp 10: Bài toán về tốc độ phản ứng được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
A. Phương pháp & ví dụ
1/ Lý thuyết và vphương pháp giải
2/ Ví dụ minh họa
Ví dụ 1: Cho phản ứng: X(khí) + Y(khí) → Z(khí) + T(khí)
Nếu tăng nồng độ chất Y lên 4 lần và nồng độ chất X giảm đi 2 lần thì tốc độ phản ứng tăng hay giảm bao nhiêu lần?
Hướng dẫn:
Vban đầu = k.[X].[Y]2=kab2 (với a, b là nồng độ chất X, Y).
Vsau = 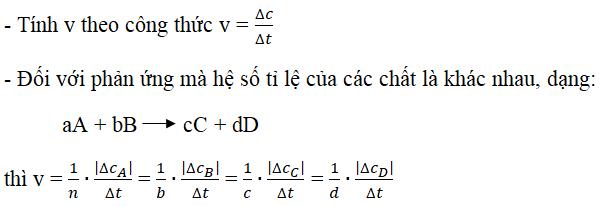 =8.kab2
=8.kab2
Vậy tốc độ tăng lên 8 lần
Ví dụ 2. Cho phản ứng: 2X(khí) + Y(khí) → Z(khí) + T(khí)
Nếu áp suất của hệ tăng 3 lần thì tốc độ phản ứng tăng hay giảm bao nhiêu lần?
Hướng dẫn:
Vban đầu = k.[X] 2.[Y] = kx2y ( với x, y là nồng độ của X, Y)
Khi áp suất của hệ tăng 3 lần thì nồng độ các chất cũng tăng gấp 3 lần .
⇒ Vsau= k.[3X] 2.[3Y]= k(3x) 2 .(3y)=27kx2y
Vậy tốc độ phản ứng tăng lên 27 lần
Ví dụ 3. Tốc độ của phản ứng tăng bao nhiêu lần nếu tăng nhiệt độ từ 200oC đến 240oC, biết rằng khi tăng 10oC thì tốc độ phản ứng tăng 2 lần.
Hướng dẫn:
Gọi V200 là tốc độ phản ứng ở 200oC
Ta có: V210= 2.V200
V220= 2V210=4V200
V230=2V220=8V200
V240=2V230=16V200
Vậy tốc độ phản ứng tăng lên 16 lần
Ví dụ 4. Cho phản ứng: A+ 2B → C
Nồng độ ban đầu các chất: [A] = 0,3M; [B] = 0,5M. Hằng số tốc độ k = 0,4
a) Tính tốc độ phản ứng lúc ban đầu.
b) Tĩnh tốc độ phản ứng tại thời điểm t khi nồng độ A giảm 0,1 mol/l.
Hướng dẫn:
a) Tốc độ ban đầu:
Vban đầu = k.[A].[B]2= 0,4.[0,3].[0,5] 2 =0,3 mol/ls
b) Tốc độ tại thời điểm t
Khi nồng độ A giảm 0,1 mol/lít thì B giảm 0,2 mol/l theo phản ứng tỉ lệ 1 : 2
Nồng độ tại thời điểm t:
[A’] = 0,3 - 0,1 =0,2 (mol/l)
[B’]=0,5 -0,2 =0,3 (mol/l)
V= k.[A’].[B’] 2= 0,4.[0,2].[0,3] 2=0,0072 mol/ls
B. Bài tập trắc nghiệm
Câu 1. Cho phản ứng A + 2B → C
Cho biết nồng độ ban đầu của A là 0,8M, của B là 0,9M và hằng số tốc độ k = 0,3. Hãy tính tốc độ phản ứng khi nồng độ chất A giảm 0,2M.
Câu 2. Cho phản ứng hóa học có dạng: A + B → C.
Tốc độ phản ứng thay đổi như thế nào khi:
a. Nồng độ A tăng 2 lần, giữ nguyên nồng độ B.
b. Nồng độ B tăng 2 lần, giữ nguyên nồng độ A.
c. Nồng độ của cả hai chất đều tăng lên 2 lần.
d. Nồng độ của chất này tăng lên 2 lần, nồng độ của chất kia giảm đi 2 lần.
e. Tăng áp suất lên 2 lần đối với hỗn hợp phản ứng, coi đây là phản ứng của các chất khí
Câu 3. Khi bắt đầu phản ứng, nồng độ của một chất là 0,024 mol/l. Sau 10s xảy ra phản ứng nồng độ của chất đó là 0,022 mol/lít. Hãy tính tốc độ phản ứng trong thời gian đó
Câu 4. Cho phản ứng Br2 + HCOOH → 2HBr + CO2
Nồng độ ban đầu của Br2 là a mol/lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.104 mol (l.s). Tính giá trị của a.
Câu 5. Cho chất xúc tác Mn2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tính tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây.
Câu 6. Khi bắt đầu phản ứng, nồng độ của một chất là 0,024 mol. Sau 20 giây phản ứng, nồng độ của chất đó là 0,020 mol. Hãy tính tốc độ trung bình của phản ứng này trong thời gian đã cho.
Câu 7. Cho phản ứng hóa học: H2(k) + I2(k) ⇋ 2HI(k)
Công thức tính tốc độ của phản ứng trên là v = k [H2] [I2]. Tốc độ của phản ứng hoa học trên sẽ tăng bao nhiêu lần khi tăng áp suất chung của hệ lên 3 lần?
Câu 8. Cho phản ứng hóa học: 2NO(k) + O2(k) → 2NO2(k)
Tốc độ phản ứng hóa học trên được tính theo công thức y = k [NO]2[O2]. Hỏi ở nhiệt độ không đổi, áp suất chung của hệ đã tăng bao nhiêu lần khi tốc độ của phản ứng tăng 64 lần?


