
Bảng hóa trị hóa học lớp 7, lớp 8, lớp 9, lớp 10 đầy đủ
Bảng hóa trị là gì?
Bạn có thể cho rằng hóa trị của các nguyên tố—số electron mà một nguyên tử sẽ liên kết hoặc hình thành—là những hóa trị có thể được suy ra bằng cách nhìn vào các nhóm (cột) của bảng tuần hoàn. Mặc dù đây là những hóa trị phổ biến nhất nhưng hoạt động thực sự của các electron lại kém đơn giản hơn.
Đây là bảng hóa trị của các nguyên tố. Hãy nhớ rằng đám mây điện tử của một nguyên tố sẽ trở nên ổn định hơn bằng cách lấp đầy, làm rỗng hoặc lấp đầy một nửa lớp vỏ. Ngoài ra, các lớp vỏ không xếp chồng lên nhau một cách gọn gàng, vì vậy đừng luôn cho rằng hóa trị của một nguyên tố được xác định bởi số lượng electron ở lớp vỏ ngoài của nó.
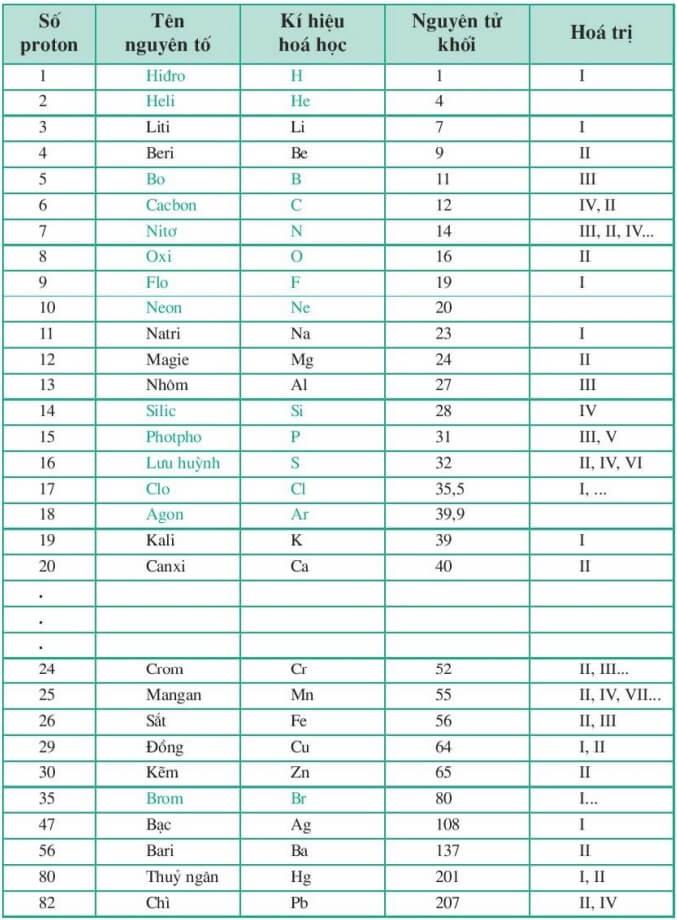
Bảng hóa trị lớp 7, lớp 8, lớp 9, lớp 10
Hóa trị của các nguyên tố là một trong những thông số quan trọng nhất mà các học sinh, sinh viên cần nắm. Nó sử dụng để viết phương trình hóa học, làm các dạng bài tập tự luận hoặc trắc nghiệm.
Thực tế chỉ có vào năm lớp 8 chúng ta mới được học một bảng hóa trị đúng nghĩa với 20 nguyên tố và các nhóm nguyên tử thông dụng đi kèm hóa trị của nó mà thôi, còn sách giáo khóa các lớp còn lại không có.
Tuy nhiên bạn hoàn toàn có thể suy ra hóa trị của một nguyên tố dựa vào vị trí của chúng trong bảng tuần hoàn. Vì các nhóm có cùng số electron lớp ngoài cùng nên chúng có cùng hóa trị. Tuy nhiên chỉ các các nguyên tố thuộc các nhóm chính (nhóm a) là các kim loại đặc trưng hoặc phi kim đặc trưng mới dễ dàng suy ra hóa trị.
Các nguyên tố thuộc nhóm phụ (nhóm b) là các kim loại chuyển tiếp có cấu hình electron phức tạp và thường có nhiều hóa trị. Cũng giống như bảng tuần hoàn, bảng hóa trị có vai trò quan trọng và được các sinh viên, học sinh và các nhà khoa học tìm kiếm hàng ngày.
Dưới đây là bảng hóa trị chi tiết:
Số nguyên tử Tên nguyên tố Hóa trị 1 Hydrogen (-1), +1 2 Helium 0 3 Lithium 1 4 Beryllium 2 5 Boron -3, +3 6 Carbon (+2), +4 7 Nitrogen-3, -2, -1, (+1), +2, +3, +4, +5
8 Oxygen -2 9 Fluorine -1, (+1) 10 Neon 0 11 Sodium 1 12 Magnesium 2 13 Aluminum 3 14 Silicon -4, (+2), +4 15 Phosphorus-3, +1, +3, +5
16 Sulfur-2, +2, +4, +6
17 Chlorine-1, +1, (+2), +3, (+4), +5, +7
18 Argon 0 19 Potassium 1 20 Calcium 2 21 Scandium 3 22 Titanium 9 23 Vanadium 14 24 Chromium 11 25 Manganese 2 26 Iron 2,3 27 Cobalt 2 28 Nickel(+1), +2, (+3), (+4)
29 Copper 1,2 30 Zinc 2 31 Gallium (+2). +3 32 Germanium -4, +2, +4 33 Arsenic-3, (+2), +3, +5
34 Selenium-2, (+2), +4, +6
35 Bromine-1, +1, (+3), (+4), +5
36 Krypton 0 37 Rubidium 1 38 Strontium 2 39 Yttrium 3 40 Zirconium(+2), (+3), +4
41 Niobium(+2), +3, (+4), +5
42 Molybdenum(+2), +3, (+4), (+5), +6
43 Technetium 6 44 Ruthenium(+2), +3, +4, (+6), (+7), +8
45 Rhodium(+2), (+3), +4, (+6)
46 Palladium 2 47 Silver 1 48 Cadmium (+1), +2 49 Indium(+1), (+2), +3
50 Tin 6 51 Antimony-3, +3, (+4), +5
52 Tellurium-2, (+2), +4, +6
53 Iodine-1, +1, (+3), (+4), +5, +7
54 Xenon 0 55 Cesium 1 56 Barium 2 57 Lanthanum 3 58 Cerium 7 59 Praseodymium 3 60 Neodymium 7 61 Promethium 3 62 Samarium (+2), +3 63 Europium (+2), +3 64 Gadolinium 3 65 Terbium 7 66 Dysprosium 3 67 Holmium 3 68 Erbium 3 69 Thulium (+2), +3 70 Ytterbium (+2), +3 71 Lutetium 3 72 Hafnium 4 73 Tantalum(+3), (+4), +5
74 Tungsten(+2), (+3), (+4), (+5), +6
75 Rhenium(-1), (+1), +2, (+3), +4, (+5), +6, +7
76 Osmium(+2), +3, +4, +6, +8
77 Iridium(+1), (+2), +3, +4, +6
78 Platinum(+1), +2, (+3), +4, +6
79 Gold 3 80 Mercury 3 81 Thallium 3 82 Lead 6 83 Bismuth(-3), (+2), +3, (+4), (+5)
84 Polonium(-2), +2, +4, (+6)
85 Astatine 1 86 Radon 0 87 Francium ? 88 Radium 2 89 Actinium 3 90 Thorium 4 91 Protactinium 5 92 Uranium(+2), +3, +4, (+5), +6
Nguồn tham khảo:
- https://bangtuanhoan.com/bang-hoa-tri
Link nội dung: https://cdsphagiang.edu.vn/dong-co-may-hoa-tri-a54637.html